EC21 makes the world trade easier
EC21 makes
the world trade easier
Issue
& Info
품목별 해외이슈
품목별 해외이슈
해외시장 진출에 꼭 필요한 품목별 최신 시장동향 및 트렌드 정보를 제공합니다
유럽 동물용 의료기기 등록 절차
품목명
미용&의료
작성자
ec21
작성일
2017-04-04 18:15
조회
2026
유럽 동물용 의료기기 등록 절차
□ 유럽 동물용 의료기기 등록 절차
- EU의 동물용 의료기기 관련 등록 절차는 크게 네 가지 방식으로 나눌 수 있음
1) National : EU 내 특정 국가의 절차에 따라 등록한 후 해당 국가에서만 판매 가능한 것
2) Mutual Recognition : 특정 국가에 등록된 제품을 협의를 통해 다른 EU 국가에도 판매할 수 있게 하는 것
3) Centralised Procudure : EU 전체 회원국에 판매 가능한 것
4) Decentralized Procudure : 특정 몇 개국에 판매가 가능한 것
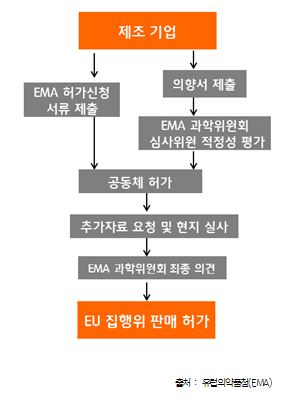
- AIC 허가는 EU 전체 회원국에서 의약품을 판매할 수 있는 ‘Centralised Procedure’임. 해당 제도를 통할 경우 유럽 27개국과 유럽 경제지역 3개국 등 총 30개국에 별도의 승인절차 없이 행정절차만 통하면 의약품을 판매할 수 있음
AIC 허가를 취득하기 위해서는 런던에 소재한 유럽의약품청(EMA)에 신청서를 제출하면 동 기관의 과학위원회에서 평가 후 최종 의견을 EU 집행위로 송부해 단일 판매허가가 발급되는 것을 원칙으로 함. 동물용의 경우 CVMP(Committee for Veterinary Product)에서 심사함
< AIC 허가 취득 절차 >
□ 영국 EU 탈퇴로 향후 인허가 제도 변화 전망
영국은 EU 탈퇴 예정으로, 탈퇴 이후 의약품, 의료기기 등의 품질기준, 임상시험 규정, 제품 승인 기준 등이 협상 결과에 따라 이원화될 가능성이 높고 과도기 동안 혼란을 겪을 것으로 예상되며, 구체적인 요건과 절차는 아직 제시되지 않음
현재까지는 신약의 임상시험 및 시판허가를 유럽의약품청(EMA)에서 받거나 유럽 인증기관을 통해 CE 인증을 받게 되면, 국가별 간략한 행정절차를 통해 EU 내 판매할 수 있었음. 하지만 탈퇴 작업이 최종적으로 마무리 되면 향후 허가 방식 및 절차와, 기존 EMA 허가제품에 대해 어떻게 진행될지 추이를 지켜볼 필요가 있음
출처 : EC21 자체조사
<문의처>
EC21 산업조사사업부 의료분야 강신웅 선임 / 02-6000-4547 / sinwoong2@ec21global.com


